Sul sito di EMA Europe troviamo oggi il documento sulle caratteristiche del vaccino Comirnaty Pfizer/Biontech. Nel punto 6 a pagina 16, ci sono due ingredienti: ALC-0315 e ALC-0159 prodotti da Echelon Biosciences Inc. https://t.co/dlofxvWk3q

ALC-0315, come puoi leggere nel documento in sotto: Questo prodotto è solo per uso di ricerca e non per uso umano. Questo prodotto è destinato alla ricerca e non all’uso umano. https://t.co/WKXdZ9vxVM

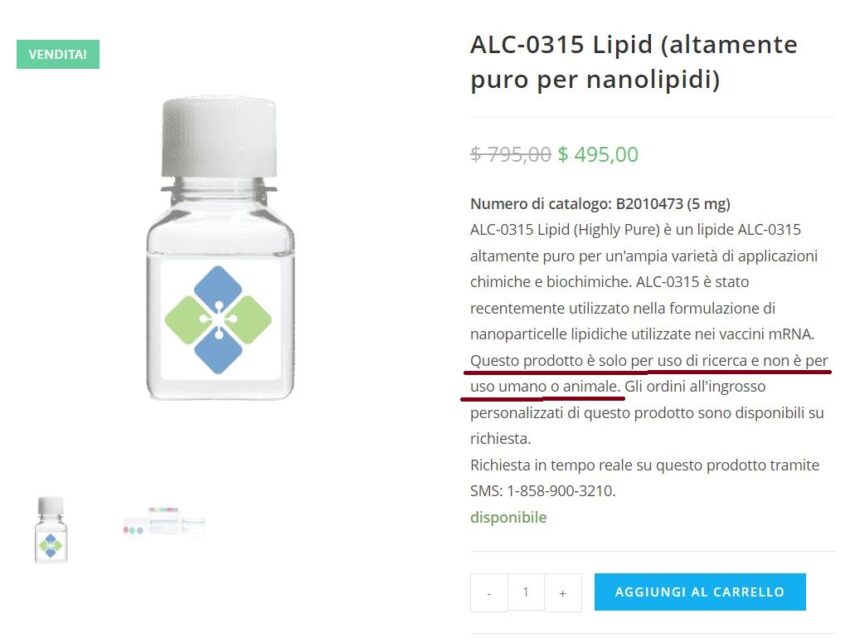
https://moleculardepot.com/product/alc-0315-lipid-highly-pure/
https://www.bmj.com/content/372/bmj.n627/rr-1
Il ricercatore Peter E. Roderick Università di Newcastle scrive a BMJ in merito alla vicenda degli eccipienti ALC-0315 e ALC-0159 contenuti nel vaccino Pfizer
caro editore
La lettura di questo importante articolo mi ha ricordato una preoccupazione che ho avuto quando ho letto ciò che il Rapporto di valutazione pubblica dell’MHRA [1] sul vaccino Pfizer/BioNtech ha detto sulle nanoparticelle lipidiche utilizzate come eccipienti – ALC-0315 e ALC-0159.
Sono nuovi eccipienti (almeno nei medicinali autorizzati nel Regno Unito) e la giustificazione per non aver condotto studi di farmacocinetica (PK) è che “generalmente non sono considerati necessari per supportare lo sviluppo e l’autorizzazione dei prodotti vaccinali per le malattie infettive (OMS, 2005; OMS, 2014)”.
Ma leggendo l’OMS, 2005 – che è un riferimento alle Linee guida dell’OMS sulla valutazione non clinica dei vaccini [2] – vedo che gli studi di farmacocinetica non sono normalmente necessari ma dovrebbero essere considerati caso per caso (paragrafo 4.2.6) ) e dovrebbero essere condotti studi di tossicità laddove vengano utilizzati nuovi eccipienti (e conservanti) per i quali non esistono dati tossicologici (paragrafo 5.2).
Faccio inoltre notare che la guida EMA 2006 ancora esistente [3] afferma che “Gli studi farmacocinetici di solito non sono richiesti per i vaccini. Tuttavia, tali studi potrebbero essere applicabili quando vengono impiegati nuovi sistemi di somministrazione o quando il vaccino contiene nuovi adiuvanti o eccipienti. La necessità di studi PK e la loro progettazione dovrebbe essere considerata caso per caso e si raccomanda che i richiedenti ottengano consulenza scientifica dalle autorità competenti dell’UE” (paragrafo 4.1). La guida del 2006 è in fase di revisione e questo testo non è presente nell’attuale bozza della versione rivista [3].
Mi sarei aspettato quindi almeno una spiegazione sul perché gli studi sulla PK non fossero considerati necessari.
Vedo anche che il rapporto di valutazione pubblica dell’EMA [4] afferma che a gennaio 2021 (e aprile 2021) “ulteriori informazioni sul processo sintetico e sulla strategia di controllo per” ALC-0315 e ALC-0159 “dovrebbero” essere fornite da BioNTech, con relazioni finali nel luglio 2021, al fine di “confermare il profilo di purezza e garantire un controllo completo della qualità e la coerenza da lotto a lotto per tutto il ciclo di vita del prodotto finito”.
Non ho competenze farmacologiche, ma mi sembra che dovrebbe essere fornita una spiegazione sul motivo per cui gli studi di farmacocinetica non sono stati considerati necessari e le informazioni aggiuntive che avrebbero dovuto essere fornite a gennaio 2021 dovrebbero essere divulgate, insieme a quelle di aprile e luglio aggiornamenti quando forniti. L’EMA dovrebbe anche spiegare perché il paragrafo 4.1 delle sue linee guida del 2006 è stato eliminato dalla sua bozza di linee guida riviste.
Cordiali saluti,
Peter Roderick
1. https://assets.publishing.service.gov.uk/government/uploads/system/uploa…
2. https://www.who.int/biologicals/publications/trs/areas/vaccines/nonclini…
3. https://www.ema.europa.eu/en/clinical-evaluation-new-vaccines#current-ef…
4. https://www.ema.europa.eu/en/medicines/human/EPAR/comirnaty#product-info…
Interessi in competizione: nessun interesse in competizione